有一位名为车胤的少年,由于家境贫寒,会在黑暗的夜晚出门捕捉萤火虫。他把它们装在白色丝袋中,照亮书本。聚集在袋子里的萤火虫们不会知道,它们的光亮,点亮了车胤官至吏部尚书的平步青云之路,也促成了比喻学习勤奋的成语“囊萤夜读”。
现在,我们返回1700年后的当下。
与车胤的故事相似,西湖大学生命科学学院PI宋春青、申恩志的团队合作,在细胞微观维度上聚拢了“萤火虫”,研发出能够更自如、更灵活地照亮DNA这本浩瀚之书的基因“探照灯”——CRISPR FISHer技术。

近日,他们的研究论文“CRISPR FISHer enables high-sensitivity imaging of nonrepetitive DNA in living cells through phase separation-mediated signal amplification”在Cell Research杂志在线发表、并被选为封面文章。
CRISPR FISHer,即实现了活细胞单拷贝基因成像的标记系统(或称,基于相分离信号放大的高敏活细胞DNA元件示踪方法),是基于CRISPR技术而来。它具有追踪任何特定细胞固有或外源DNA序列的潜力,极大地拓宽了活细胞成像的应用范围,为生物学过程研究和生物医学诊断的进一步发展奠定了基础。
原文链接:https://www.nature.com/articles/s41422-022-00712-z
“基因剪刀”CRISPR:我可以照亮基因之书
我们都知道,你之所以是你,我之所以是我,是由于我们每个人拥有着独一无二的基因组(指生物体所有遗传物质的总和)。基因组就像是一本特别的书,以基因片段为“字词”,记载着我们的个人信息,也将在我们的一生中发挥重要作用。
CRISPR技术,是基因编辑技术的一种,常被比拟为“基因剪刀”。它能够针对性地对基因组之书的错误靶点进行剪切,在提供模板的情况下可以进行错误“纠正”——简要理解,就是找到错误的地方,“剪”掉错误的内容,然后“替换”成正确的字词。
这得益于它的核心组成部分,gRNA和Cas9 蛋白。gRNA(也叫guide RNA,即向导RNA),是这把“剪刀”的导航,能够在基因组的“字词”海洋里找到出错的地方、规划抵达的路线;Cas9核酸内切酶,则是“剪刀”的刀锋,能沿着路线抵达指定位置,并一刀切下去。
当然,以上是CRISPR技术最基础的应用方式,随着CRISPR基因编辑技术的发展,2013年,科学家们发现了CRISPR的另一种作用——“剪刀”丧失剪切功能(dCas9,即核酸酶失活形式的Cas9),但却带着“灯”(EGFP,增强绿色荧光蛋白)锁定并照亮基因组的“段落”;自此,CRISPR成像技术在基因成像领域崭露头角。
这种带“灯”的CRISPR有什么用?
比如,我们可以去观察基因本身,去看一个染色体的状态、记录染色体的运动,也就是当下“流行”的4D染色体研究;又比如,我们可以观察病毒DNA入侵细胞的过程;再比如,可以帮助我们研究癌症的原理,研究诸如染色体易位这样的异常染色体状态与癌症发生的关系;还有,我们可以观察携带基因的载体是否将DNA带到“目的地”,例如,实时动态追踪用于治疗遗传性视网膜疾病和脊髓性肌萎缩症的AAV载体是否承载了疗效基因……
看到了这盏“灯”的强大作用后,很多科学家开始聚焦于基于CRISPR技术的活细胞成像研究。最初科学家通过增加向导RNA(即gRNA,“导航”)的量来招募更多的荧光蛋白(即“灯”)照亮局部位点,但是多个“导航”很难同时进入同一个细胞;与此同时,在细胞中游离的“灯”会产生很强的背景光亮,这就使得目标位点的光照分辨率变的很低。2016年,CRISPRainbow活细胞成像系统面世,它像一串彩虹色“霓虹灯”,能实现基因组不同位点的标记;2018年,又诞生了CRISPR-Sirius系统,一个“导航”能够携带更多个数的“灯泡”,从而实现更高分辨率的成像……
CRISPR FISHer: 强大的“基因探照灯”,来了!
较之在基因成像领域更传统、更广泛应用的DNA原位杂交技术(需要将细胞固定,DNA变性后才能实现,不能实时记录DNA的状态),基于CRISPR技术的“灯”可以在细胞中的靶位点DNA非变性的情况下,实现DNA在活细胞内的动态成像。然而,这样的“灯”目前能照亮、使我们能读到的,仅限于基因组的“书”中那些在同一页中重复出现的内容,也就是临近位置重复出现多次的DNA序列(即成簇存在的多拷贝位点)。
而在我们人类的基因组的“书”中,大多数都是非重复的内容,即单拷贝基因。于是,超过65%的人类基因组序列利用现有的成像系统很难检测得到。也就是说,现在给基因“书”用的“灯”,不管怎么打造,总是不够“亮”,很难让我们看清书中那些处于细微处且只出现一次的“字词”。
是否可以做出一盏更厉害的基因灯?有了这个理想,西湖大学宋春青实验室和申恩志实验室合作,历经近两年,最终,CRISPR FISHer诞生了。
东晋少年车胤之所以聚拢萤火虫,是因为单只萤火虫的光很微弱,且它们分散在大自然中,无法照亮书页;但在聚集后,微弱之光便变强了。同样的,CRISPR FISHer系统,正是在先前版本的CRISPR成像系统上,聚拢了更多的“灯”,实现了在基因维度更强大的成像功能——因而,我们无惧所需照亮的基因“字词”之细小,能够阅读DNA书本的更多细节内容了。
具体来说,该系统由dCas9蛋白,包含2个PP7配体的sgRNA(sgRNA-2×PP7)和foldon-GFP-PCP蛋白组成。在成像标记的过程中,dCas9(即“钝刀”的刀锋,上文所述的不会切割的Cas9蛋白)和sgRNA-2×PP7(可理解为导航兼连接支架)会首先在目标DNA序列位点稳定结合,并充当“种子”,使得foldon-GFP-PCP(即“灯”)和其余的sgRNA-2×PP7在目标DNA位点处快速聚集,从而通过相分离的方式最大化募集GFP荧光蛋白“灯”至标记位点(可以理解为形成更庞大的串联的结构,“刀锋-支架-灯”基础上,可以继续串联更多的“支架-灯”结构,形成“刀锋-支架-灯-支架-灯-支架-灯……”),同时大大降低细胞核背景中弥散的GFP信号(如图一)。
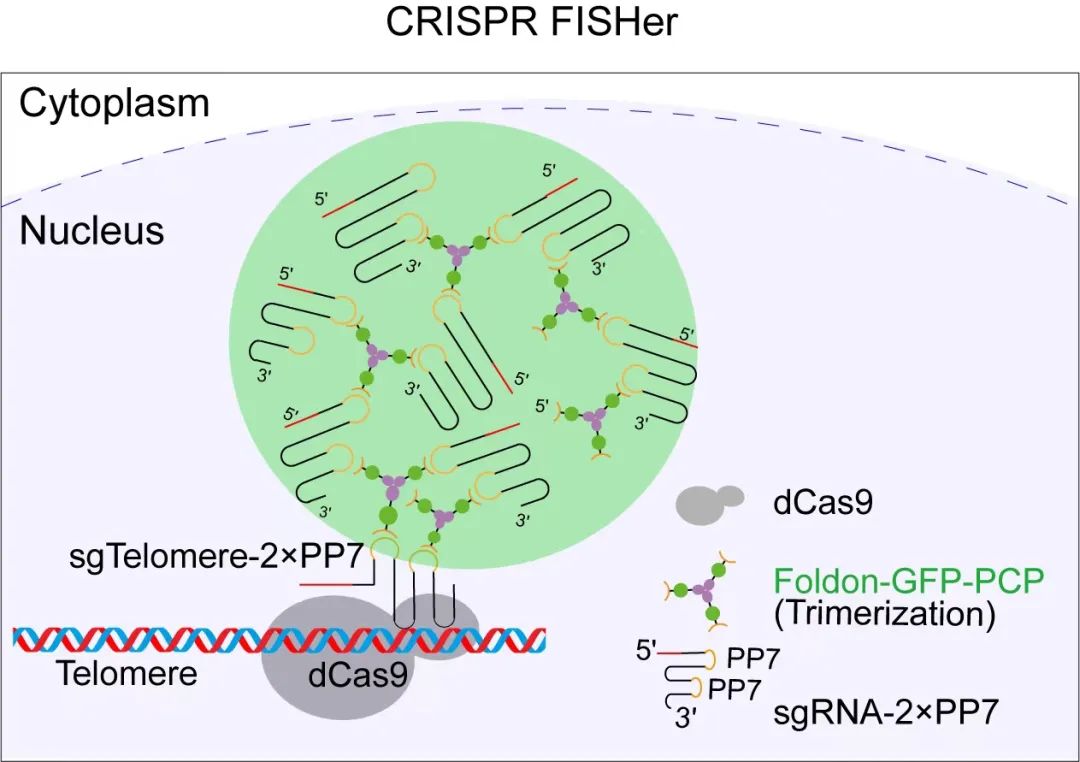
图一
随后,为了验证CRISPR FISHer系统的功能是否强大,研究团队开展了一系列验证实验。
他们证实,CRISPR FISHer超越了已有“基因灯”的技术。在相同的拍摄条件下,CRISPR FISHer所标记的端粒荧光强度信噪比最高可以达到246,远远高于传统的成像系统(信噪比在2左右)(图二)。这说明,在照亮基因“书”的重复内容时,因为光更强,所以我们有机会看得更清楚了。
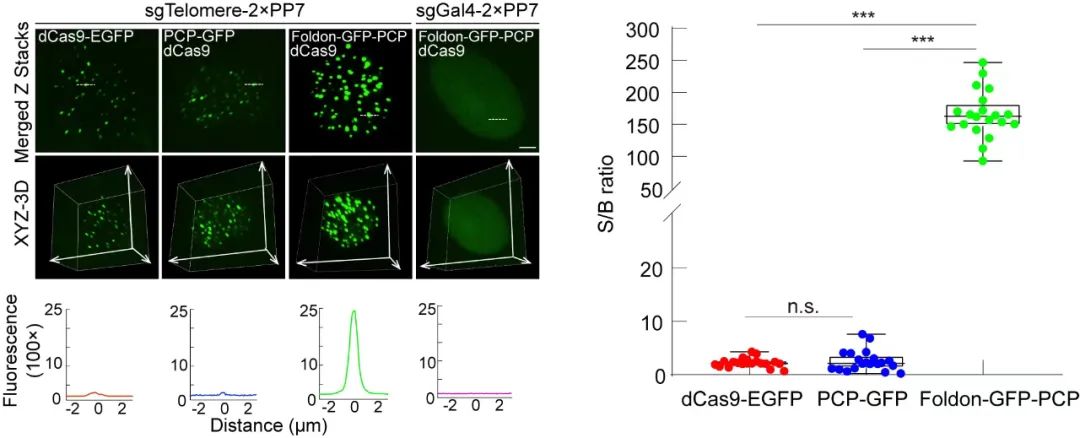
图二
之后他们证实,那些在书中仅仅出现一次的内容,也就是之前人类没法“看到”的那些单拷贝基因,现在也能看清了。团队发现,相对于对照组细胞呈现出的弥散绿色荧光信号,在CRISPR FISHer所标记的PPP1R2基因的细胞中可以明显的观察到2-4个荧光信号点(如图三a和图三b),这说明CRISPR FISHer系统是具备单拷贝基因成像标记能力的,并且在单拷贝基因的成像标记过程中表现出很好的特异性,能够“看到”基因“书”中的特定的、只出现一次的“字词”内容。
最让研究团队兴奋的是,他们发现——当基因“书”被某些因素影响发生改变,成了不常规的“书”,比如,基因组不稳定性或染色体结构变异可诱导 DNA损伤和修复,有时会产生染色体外的DNA;或者,一些外源入侵者,例如病毒,可以感染细胞并将其基因组传递到细胞核中,导致细胞功能障碍和疾病的发生发展——这些时候,这盏“灯”依然能带着我们看清楚最新情况。
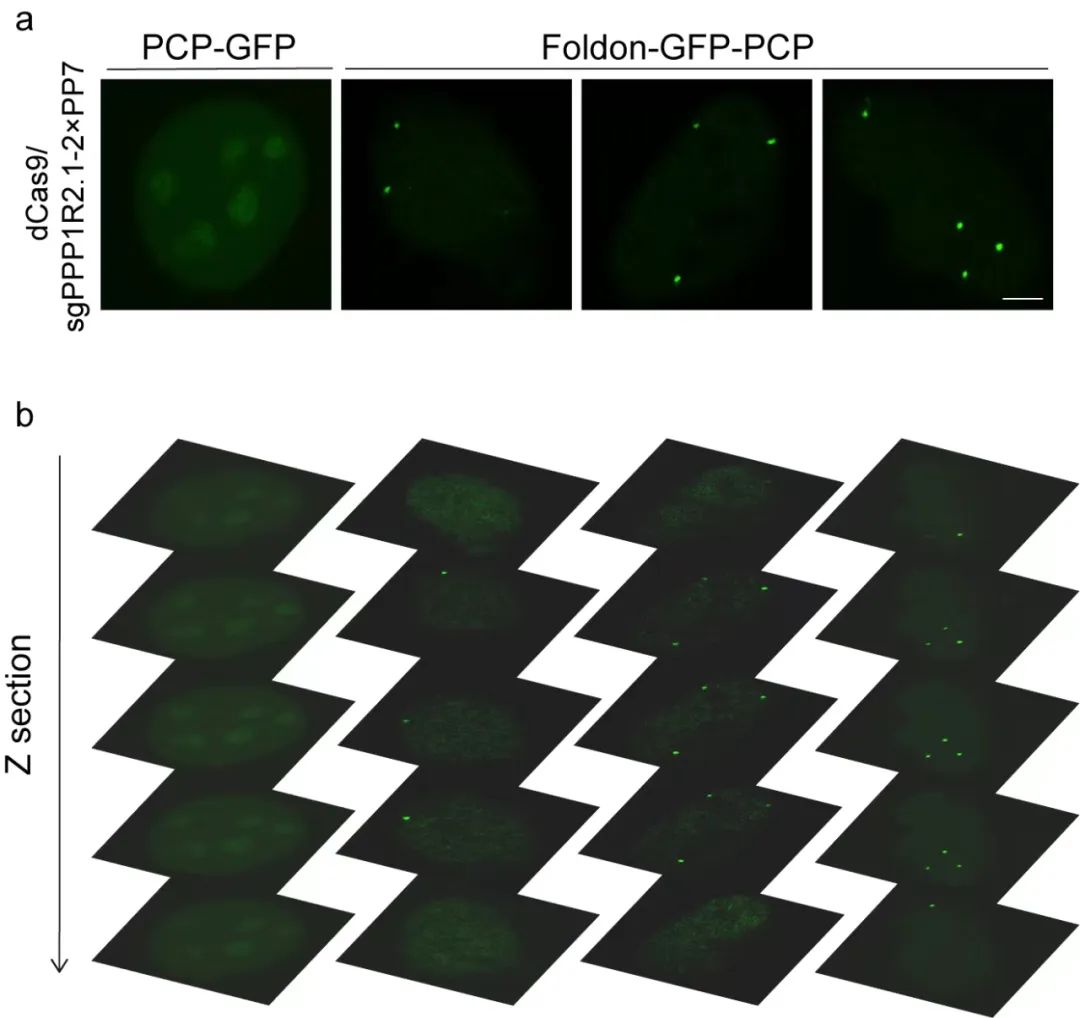
图三
从利刃到钝刀,他们致力于“透视”基因层面的人类病痛
不知道千百年前,终于以萤虫之光照亮夜间学海之路的车胤,是否为此激动不已。总之对于创新了CRISPR FISHer活细胞单拷贝基因成像标记系统的宋春青团队和申恩志团队来说,他们对于打造一盏世界上前所未有的“灯”,去照亮、去看见那些在“黑暗”中的基因,等待已久。

研究团队
从有想法到最终实现,他们整整走了近两年。事实上,两年是往短了说的。这次之所以能够实现原创的突破性的基因成像技术,与研究者们关于CRISPR更早期、更长年累月的研究密不可分。
早在2015年至2019年在麻省大学医学院RNA治疗研究所进行博士后研究时,宋春青接触了CRISPR技术,并且练就了如何在“利刃”CRISPR上玩出花的本领——也就是常规意义上的“基因剪刀”的基因编辑功用。正是基于“利刃”的研究经验,熟悉了CRISPR的基本原理,做“钝刀”灯,才会势如破竹。

宋春青
展望未来,CRISPR FISHer由于拥有能够追踪任何特定内源或外源DNA序列的潜力,将极大地拓宽了活细胞成像技术的应用范围,为生物学过程研究和生物医学诊断的发展奠定基础。换句话说,拥有了这盏超强基因“探照灯”,我们能够看到基因的更多动态,挖掘更多关于人类身体机理和疾病的“秘密”。
西湖大学生命科学学院宋春青课题组2020级博士生吕欣原,博士后邓远,2020级博士生黄晓燕,和申恩志课题组2020级博士生李珍珍为该论文的共同第一作者。西湖大学生命科学学院宋春青研究员和申恩志研究员为该论文的共同通讯作者。
Ref.
1. Ain, Q., et al., Extrachromosomal Circular DNA: Current Knowledge and Implications for CNS Aging and Neurodegeneration. 2020. 21(7): p. 2477.2. Foxman, E.F. and A.J.N.R.M. Iwasaki, Genome-virome interactions: examining the role of common viral infections in complex disease.2011. 9(4): p. 254-264.3. Schwarzacher, T. and J.S.J.M.i.M.B. Heslop-Harrison, Direct fluorochrome-labeled DNA probes for direct fluorescent in situ hybridization to chromosomes. 1994. 28: p. 167.4. Qi, L.S., et al., Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. 2013. 152(5): p. 1173-1183.5. Chen, B., et al., Dynamic Imaging of Genomic Loci in Living Human Cells by an Optimized CRISPR/Cas System. 2013. 155(7): p. 1479-1491.6. Ma, H., et al., Multiplexed labeling of genomic loci with dCas9 and engineered sgRNAs using CRISPRainbow. 2016.7. Ma, H., et al., CRISPR-Sirius: RNA scaffolds for signal amplification in genome imaging. 2018. 15(11).8. Sawada, H. and G.F. Saunders, Transcription of Nonrepetitive DNA in Human Tissues. 1974. 34(3): p. 516-520.9. Xu, H., et al., TriTag: an integrative tool to correlate chromatin dynamics and gene expression in living cells. 2020.10. Gu, B., et al., Transcription-coupled changes in nuclear mobility of mammalian cis-regulatory elements. 2018. 359(6379): p. 1050-1055.
实验室招聘
宋春青研究组主要通过CRISPR技术建立小鼠模型,运用细胞生物学、分子生物学及其生物信息学等手段来解析肝癌以及组织再生和衰老的分子机制。此外实验室聚焦于CRISPR相关的技术的改进、应用和遗传性疾病的修复。
实验室主页:
http://songlab.web.zhanhi.com/vip_songlab.html
申恩志课题组主要集中于非编码核酸(non-coding RNA,ncRNA)的研究,ncRNA是转录组的主要组成部分,广泛参与细胞的一系列生物学过程,对生物体的功能调节起着至关重要的作用。例如,小非编码核酸siRNA、miRNA和piRNA(Piwi-interacting RNA)可以靶向调节基因的表达,进而确保生物体转录组的稳定和生殖发育的正常进行。以线虫和小鼠为模式生物,集中在系统研究piRNA的生物学功能和作用机制。
实验室介绍:
https://sls.westlake.edu.cn/Our_Faculty/202006/t20200617_5886.shtml
实验室长期招聘科研助理、博士后和助理研究员,欢迎有志之士加盟!
简历投递到 songlab@westlake.edu.cn; shenenzhi@westlake.edu.cn。